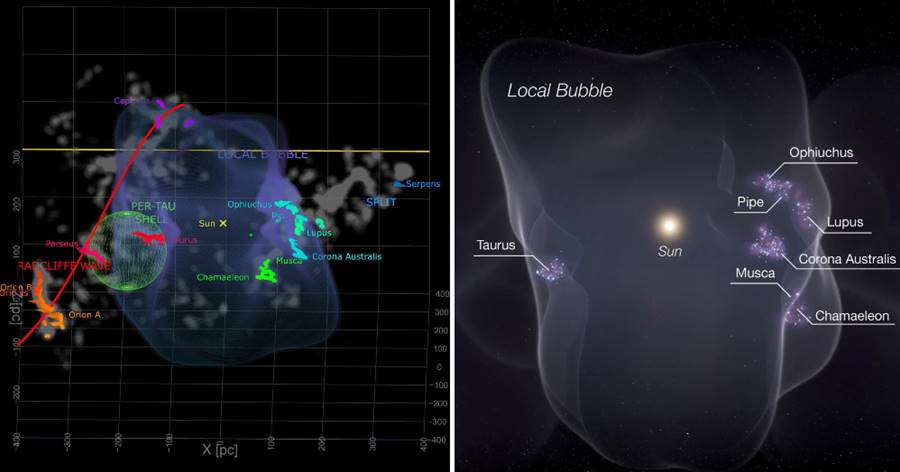
原子是一種微觀結構,我們身邊的所有物質都是由原子所構成的,比如氫是由氫原子所構成的,鐵是由鐵原子所構成的。
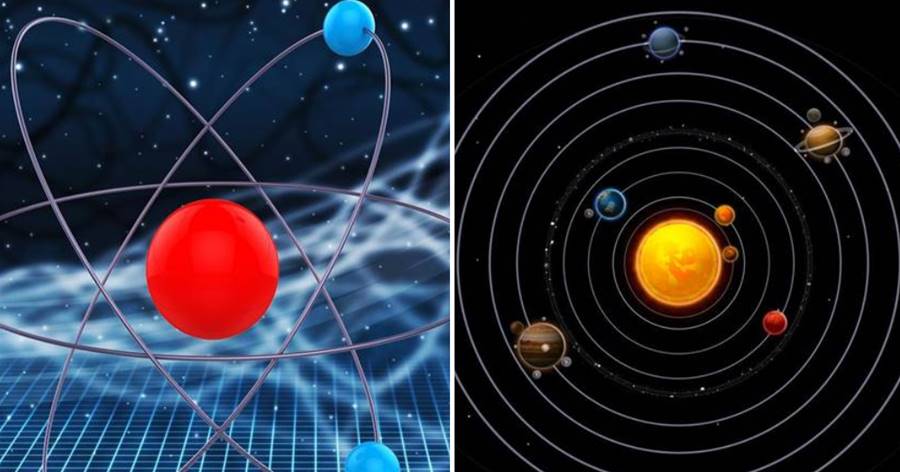
既然原子是一切物質的基礎結構,那麼原子到底是個什麼樣子呢?原子是由兩部分組成的,即原子核與核外電子,有人說一個原子就是一個微縮的恒星系,原子核就是恒星,而電子就是圍繞恒星運行的行星,真是如此嗎?這個比喻有一些道理,但卻算不上正確,因為原子是一個比恒星系更加有序的系統,其中每一個電子的運動都嚴格遵循著某些規則。

當然,一個恒星系也是一個有序的天體系統,其中的每一顆星體都在引力的作用下進行著特定的運動。
然而,宇宙中的恒星系眾多,每一個都大不相同,你無法在親眼得見之前就準確描繪出一個恒星系的準確模樣,但原子就不同了,只要你了解了其中的規則就可以畫出它的樣子。
你可能以為原子就像行星那樣在原子核的外圍一遍一遍地繞行,但其實不是,每一個電子都有其特定的軌道,這個軌道就被稱為「原子軌道」,而每一個軌道的樣子又大有不同。

什麼是原子軌道呢?這先要從電子層說起。
在原子核的外面是一層一層的電子層,最多可以有7層,不過電子層并不是原子軌道,它只是一個區域,在每一個區域之中還有著更為詳細的劃分。每一個電子層中包含有不同的能級,不同的電子層所擁有的能級數量是不同的,而這個能級就是原子軌道。距離原子核最近的第一個電子層只有一個能級,而第二個電子層有兩個能級,第三個電子層則有三個能級,以此類推,第七個電子層自然就有7個能級了。

能級雖然就是原子軌道,但并不意味著有幾個能級就有幾個原子軌道。
目前在已知的所有元素中共發現了四個能級,分別表示為s能級、p能級、d能級、f能級。第一個電子層中有一個能級,就是s能級,也就是有一個原子軌道。第二個電子層中有兩個能級,即s能級和p能級,但并不是說第二個電子層中只有兩個原子軌道,而是有三個原子軌道。為什麼呢?因為p軌道都是三個一起出現的,也就是說在第二個電子層中有一個s軌道和三個p軌道,一共四個原子軌道。

s能級有一個s軌道,p能級有三個p軌道,d能級有五個d軌道,f能級有7個f軌道。
據此,我們很容易就能夠確定第三個電子層有9個原子軌道,因為第三層有一個s能級,即1個s軌道,一個p能級,即3個p軌道,一個d能級,即5個d軌道,加起來剛好9個。
現在我們已經知道了原子軌道是如何分布的,那麼一個軌道上能容納幾個電子呢?根據泡利不相容原理,一個原子軌道上最多只能容納2個電子。知道了原子軌道的分布規則,也知道了一個軌道最多容納的電子數量,但現在還是無法直接描繪出一個原子中電子的分布情況,我們還需要知道另一個規則。

這個規則就是能量最低原則。
什麼意思呢?就是電子總是搶先占據能量最低的原子軌道。同樣都是s軌道,第一個電子層的s軌道的能量就要小于第二個電子層中s軌道的能量,而第二個電子層中的s軌道的能量則要小于第三個電子層中s軌道的能量。在同一個電子層中,s軌道的能量要小于p軌道,p軌道的能量要小于d軌道,以此類推。根據上述所有規則,我們就可以準確地描繪出任何一個原子的結構,比如擁有8個電子的氧原子,是不是很容易就能想象出它的樣子了?原子結構就是如此有序,比恒星系統可要有序得多呢。